la molécule dipolaire
La molécule d'eau est dite dipolaire. En effet, ce caractère dipolaire de la molécule H2O est du au fait que l'atome d’oxygène est plus électronégatif que celui d'hydrogène. Il attire donc plus les électrons que l’hydrogène. L’oxygène porte donc un excès de charges négatives alors que l’hydrogène, éloigné de son unique électron devient chargé positivement. On distingue alors deux pôles dans la molécule un pôle positif au niveau des atomes H et un pôle négatif vers l’atome d’oxygène. Les atomes H d'une molécule, chargés légèrement positivement sont alors attirés par des atomes d’oxygène chargés négativement de molécules voisines. La force d'attraction entre les deux molécules est suffisante pour aboutir à une liaison stable : une liaison hydrogène. Seule l'eau a autant de liaisons hydrogène que de liaisons covalentes, deux de chaque, soit 10 fois plus que toutes les autres molécules. La liaison hydrogène est donc une liaison intermoléculaire qui joue un rôle fondamental dans la nature.
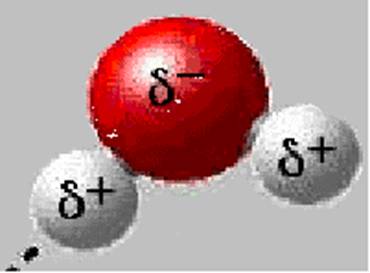 Le Caractère dipolaire de la molécule d’eau
Le Caractère dipolaire de la molécule d’eau