l'état liquide
Dès que la température de l'eau dépasse 0°C, le cristal, autrement dit la glace, devient instable: les liaisons hydrogène se tordent, car elles ne sont plus suffisamment fortes pour lutter contre l'énergie apportée par la température. Ainsi, la rigidité des tétraèdres, formés à l'état solide, s'affaiblit, ce qui donne une certaine liberté aux molécules d'eau. A l'échelle microscopique, la structure vibre, elle est en perpétuel mouvement. Ainsi la structure de l'eau devient instable, transitoire, comparée à celle de la glace qui est géométrique et stable. L'eau liquide adopte une structure plus compacte que la glace car lorsque les liaisons hydrogène se brisent ou se tordent, les oxygènes peuvent se rapprocher légèrement les uns des autres ce qui aboutit à une configuration plus compacte et plus dense, il y a comme un affaissement de la structure. Un autre phénomène permet à l'eau de changer d'état, de passer de l’état solide à l’état liquide. Ce phénomène résulte de la structure des molécules. En effet, l'application d'une forte pression à température constante tend à diminuer le volume occupé par chaque molécule et conduit à la rupture ou la torsion d'un certain nombre de liaisons hydrogène, d’où la encore la fonte de la glace. Ce phénomène s'appelle la fusion par suppression, elle est spécifique à l'eau.
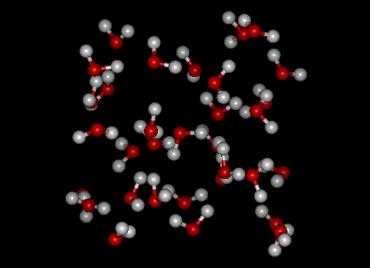
Représentation de la structure et de l’assemblage des molécules d’eau à l’état liquide
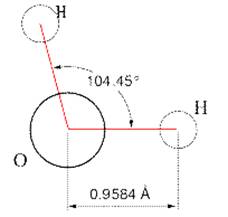
Schéma montrant la disposition des atomes d’oxygène et d’hydrogène d’une molécule d’eau à l’état liquide
Les angles entre les noyaux des molécules H-O-H sont de 104° à l'état liquide alors qu’à l’état solide, ces angles sont de 180° , c’est à dire qu’ils sont maximales. Cette différence dans la disposition explique le fait que la glace soit moins dense que l’eau liquide. En effet, l’angle entre les noyaux des différents atomes O et H étant plus grand à l’état solide qu’à l’état liquide, il en résulte que, pour un même nombre de molécules, le volume occupé par ces molécules d’eau est plus important à l’état solide qu’à l’état liquide, et donc que la densité de l’eau est plus grande à l’état liquide qu’à l’état solide. Cette situation se produit lors de la fonte des glaces on peut voir que les iceberg par exemples flottent sur l'eau: la densité de la glace est 8% inférieure à celle de l'eau liquide.

ILOT DANS L’ARCHIPEL DE SULU, Philippines extrait de la terre vu du ciel de Yann Arthus Bertrand